Kolagen typu II jest głównym składnikiem budulcowym chrząstki stawowej, która
pokrywa powierzchnie kości tworzących dany staw. Jest białkiem strukturalnym, które
zapewnia elastyczność i wytrzymałość chrząstki podczas ruchu. Gdy chrząstka, pokrywająca
powierzchnie stawowe, ulega uszkodzeniu lub zużyciu z wiekiem, podczas ruchu zaczynają
występować dolegliwości bólowe. Jest to wynikiem odsłonięcia i drażnienia receptorów
bólowych w stawie. Suplementacja kolagenu typu II wspomaga odbudowę i utrzymanie
zdrowia chrząstki stawowej. Kolagen typu II wspiera proces regeneracji chrząstki stawowej
poprzez dostarczenie organizmowi niezbędnych aminokwasów i składników odżywczych
potrzebnych do syntezy nowej chrząstki.
Kolagen typu II występuje także w ścięgnach i więzadłach, choć tkanki miękkie
wchodzące w skład układu ruchu składają się głównie z kolagenu typu I. Suplementacja
zhydrolizowanym kolagenem typu II dostarcza organizmowi składników potrzebnych do
wzmacniania i utrzymania zdrowej struktury tych tkanek. Spożywanie kolagenu drobiowego
typu II stymuluje produkcję wszystkich rodzajów kolagenu, w tym kolagenu typu I.
Prawidłowo zbudowane tkanki miękkie są istotne dla utrzymania stabilności stawów
i możliwości wykonywania ruchu w pełnym zakresie bez dolegliwości bólowych.
Kolagen typu II jest głównym składnikiem białkowym elementów chrzęstnych, jakie
występują w układzie ruchu człowieka. Jest głównym składnikiem chrząstek stawowych,
które pokrywają wszystkie powierzchnie stawowe w organiźmie. Zapewnia płynność ruchu,
amortyzację oraz stabilność stawów. Jest też składnikiem budulcowym pierścienia
włóknistego krążków międzykręgowych, którego zadaniem jest utrzymanie we właściwym
położeniu jądra miażdżystego, czyli galaretowatego rdzenia krążka. Suplementacja kolagenu
typu II pomaga w utrzymaniu zdrowej chrząstki stawowej, a w przypadku jej uszkodzeń
przyczynia się do jej regeneracji, redukcji bólu oraz poprawy ruchomości.
Białka, kolagen typu II i elastyna są głównymi składnikami budulcowymi pierścienia
włóknistego krążków międzykręgowych kręgosłupa. Ich zadaniem jest utrzymanie we
właściwym położeniu jądra miażdżystego, czyli galaretowatego rdzenia krążka. Krążek
międzykręgowy jest amortyzatorem kręgosłupa i zapewnia mu ruchomość. Dzięki krążkom,
potocznie nazywanymi dyskami, kręgi nie ocierają się o siebie. Z wiekiem i w wyniku
uszkodzeń, dochodzi do zaburzenia elastyczności pierścieni włóknistych krążków
międzykręgowych, co skutkuje rozwojem dyskopatii i występowaniem dolegliwości
bólowych kręgosłupa. Suplementacja kolagenu typu II może wspomagać utrzymanie
prawidłowej budowy i funkcji krążków międzykręgowych .
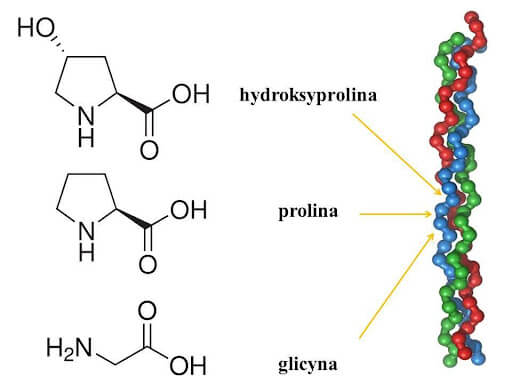
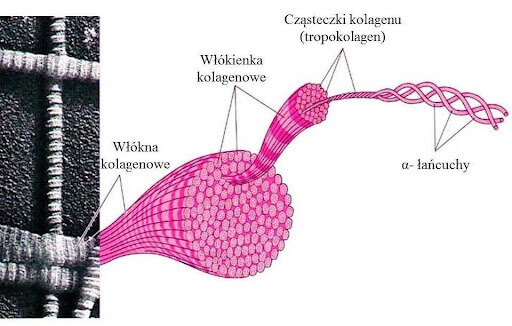
Kolagen jest najbardziej rozpowszechnionym białkiem zwierzęcym i stanowi
w organizmie człowieka ok. 1/3 wszystkich białek. Kolagen typu I jest jednym z głównych
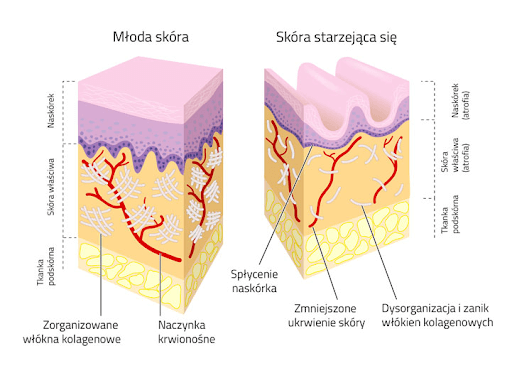
składników budulcowych skóry, który zapewnia jej elastyczność, jędrność i gładkość.
Suplementacja kolagenem typu II ma również korzystny wpływ na stan zdrowia skóry,
włosów i paznokci poprzez dostarczanie niezbędnych składników odżywczych, które są
istotne do utrzymania ich elastyczności, wytrzymałości, dobrej kondycji i regeneracji.